Взаимодействие серы с натрием уравнение. Взаимодействие серы с водородом
Взаимодействие серы с водородом. 2). Взаимодействие с водородом. S + H02 ? H+2S -2. S0 +2e ? S-2 1 ок-тель. Восстановления. H02 - 2e ? 2H+ 1 вос-тель. Окисления. Вывод: с металлами, с водородом сера проявляет окислительные свойства. 03.10.2014. 10.
Слайд 10 из презентации «Химические свойства серы» . Размер архива с презентацией 247 КБ.Химия 9 класс
краткое содержание других презентаций«Металлы в жизни человека» - Использование сплавов в наше время. Сплавы и их свойства. Металлы и сплавы в жизни человека. Сплавы в покорении новых высот. Амальгама. Получение сплавов. Использование сплавов в средние века. Первые металлы. Металлические находки. Что же такое сплавы.
«Химический элемент фосфор» - Относительная атомная масса. Рыхлый порошок. Фосфор в природе. Теоретический материал. Электронная формула. Особенности фосфора. Химические свойства. Проявляет свойства кислотного оксида. Применение P2O5. Физические свойства. Применение. Аллотропные модификации фосфора. Получение. Фосфор. Фосфор активен с кислородом. Образуется при горении. Важнейшие соединения.
«Изделия из металлов» - Век медный. Чугунное литье. Часы истории. Медный всадник. Железный век. Сталь. Изделия, содержащие сталь. Чистое железо не ржавеет. Век медный, бронзовый, железный. Изделия из бронзы. Царь - пушка. Древнеримская медная монета. Использование камня. Метеоритное железо. Бронзовый век. Конная статуя Марка Аврелия. Бронза. Золото. Царь - колокол. Украшения из меди. Железо. Бронзовая статуэтка. Чугун. Колосс Родосский.
«Азотная кислота по химии» - Запишите формулу. Вопросы на закрепление. Пора подвести итог. Азотная кислота HNO3. Расположите соединения азота. Окислительные свойства. Вещества, с которыми может реагировать азотная кислота. Азотная кислота. Составьте уравнения реакций. Химические свойства. Характеристика. Физические свойства. HNO3.
«Элемент платина» - Что такое «платина». Химические свойства. Что делаем с платиной мы. Интересные факты. Платина. Искушение вечностью. Проба. Физические свойства. Что делали с платиной наши предки. Металл. Применение. Удивительная чистота.
«Вещества-неметаллы» - Критерии оценок. Наличие генетической связи. Уравнения реакций. Реактивы. Особенностей строения атомов. Видеофрагмент. Ключевые моменты. Неметалл-окислитель. Разновидности простого вещества. Неметаллы. Степени окисления. Осуществите цепочку превращений. Аллотропия. Ион аммония.
Это химический элемент, расположенный в шестой группе, третьем периоде таблицы Менделеева. Это хрупкое вещество, пребывающее при нормальных условиях в твердом агрегатном состоянии. Сера окрашена в лимонно-желтый цвет. Таким же оттенком наделены многие соединения этого элемента.
Физические характеристики серы
Сера не растворяется в воде, обладает низкой электро- и теплопроводностью, проявляет свойства типичного неметалла. Вещество может пребывать в нескольких вариациях, в зависимости от строения кристаллической решетки, соединяющей атомы.
Первый вариант элемента - ромбическая сера , наиболее устойчивое вещество. Кипит при температуре 445 °C. Перед переходом в газообразное агрегатное состояние это вещество должно стать жидким. Плавится ромбическая сера при температуре 113 °C.
Второй вариант - моноклинная сера , представляющая собой кристаллы игольчатой формы темно-желтого цвета. Это вещество формируется в результате плавления ромбической серы и медленного ее охлаждения. Температура кипения моноклинной серы - 445 °С. Существует пластическая разновидность моноклинной серы, которую получают путем выливания почти кипящей ромбической серы в холодную воду. Это вещество обладает свойством тянуться наподобие резины.
Температура воспламенения серы зависит от типа материала и его происхождения. Например, сера техническая воспламеняется при температуре 190 °С. При других условиях температура вспышки серы составляет 248 °С и даже 256 °С - в зависимости от того, из какого материала была добыта сера и какую плотность имеет вещество. В любом случае температура горения серы достаточно низкая, по сравнению с другими химическими элементами. Сера относится к легковоспламеняющимся веществам.
Химические характеристики серы, ее взаимодействие с металлами
Сера обладает сравнительно низкой атомной массой (32 г/моль). Элемент может иметь разные степени окисления. Этим сера отличается от кислорода или водорода. Сера, в зависимости от условий, способна проявлять восстановительные или окислительные свойства.
Для реакции серы с металлами необходима высокая температура. При таких условиях будет протекать реакция присоединения: атомы металла объединятся с атомами серы, образуя сложные вещества - сульфиды. К примеру, если нагреть 2 моля калия, смешать их с 1 молем серы, образуется 1 моль сульфида калия. Уравнение реакции:
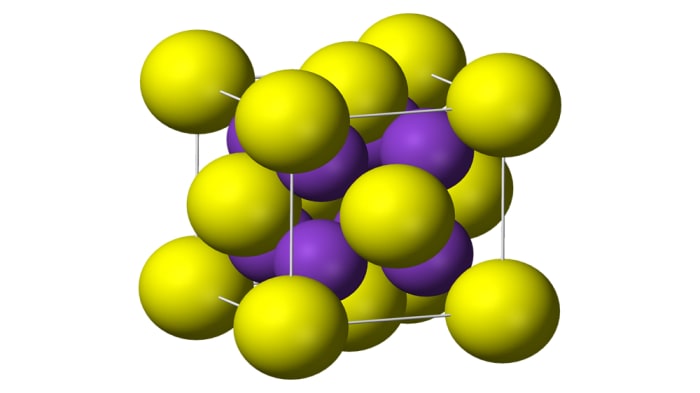 Молекулярная структура сульфида калия
Молекулярная структура сульфида калия
Реакция серы с галогенами и другими простыми веществами
Сера, как и другие неметаллы, вступает в реакцию с галогенами. Сера реагирует с бромом, фтором, хлором, но не взаимодействует с иодом. Пример - фторирование серы. Если разогреть серу с галогеном, образуются две вариации фторида.
 Молекулярная структура фторида серы
Молекулярная структура фторида серы
Первый вариант : взять 1 моль серы и три 3 моля фтора, образуется 1 моль фторида - SF₆. Уравнение реакции:
S + 3F₂ = SF₆
Второй вариант : взять 1 моль серы и 2 моля фтора, образуется 1 моль фторида с химической формулой SF₄. Уравнение реакции:
S + 2F₂ = SF₄
Реакция галогенов с серой зависит от пропорций, в которых смешаны компоненты. Таким же образом осуществляется бромирование серы либо хлорирование серы (в результате реакции также образуются два разных вещества).
Сера вступает в химическую реакцию с фосфором, водородом и углеродом. При взаимодействии серы с водородом образуется сероводород. В результате реакции сероводорода с металлами образуются их сульфиды, которые также получают прямым взаимодействием серы с тем же металлом.
Присоединение атомов водорода к атомам серы происходит исключительно в условиях очень высокой температуры. При реакции серы с фосфором образуется фосфид серы - P₂S₃. Чтобы получить 1 моль фосфида серы, нужно взять 2 моля фосфора и 3 моля «сульфура». При реакции серы с углеродом образуется сероуглерод CS₂. Чтобы получить 1 моль сероуглерода, нужно взять 1 моль углерода и 2 моля серы. Описанные реакции присоединения протекают при нагревании реагентов до высоких температур. С желтым порошком серы можно провести интересный опыт и расплавить его в черную вязкую массу.
Реакция серы с кислородом
Нельзя рассмотреть все реакции с серой и упустить ее взаимодействие с кислородом. Для понимания процесса можно провести лабораторный опыт: в ходе реакции разложения марганцовки колба наполнится кислородом. Затем поджигается сера в ложечке для сгорания и опускается в колбу с кислородом. Сера интенсивно сгорает на воздухе ярким сине-фиолетовым пламенем. Постепенно колбу заполнит белый туман.
 Горение серы
Горение серы
Реакция между кислородом и серой принадлежит к числу окислительно-восстановительных, где сера - восстановитель, а кислород - окислитель. Скорость горения серы в чистом кислороде увеличивается за счет почти пятикратного увеличения концентрации кислорода.
Тепло при горении серы на воздухе не расходуется на нагревание балласта (азота), поэтому температура реагентов повышается сильнее, чем на воздухе. Из-за этого интенсивность горения тоже увеличивается. При горении сера соединяется с кислородом, образуя сернистый газ - оксид серы SO₂, который постепенно заполняет цилиндр. Уравнение реакции:
S + O₂ = SO₂ + Q.
Сернистый газ, соединяясь с парами воды, образует сернистую кислоту:
SO₂ + H₂O = H₂SO₃
Сернистая кислота окисляется до серной кислоты:
2H₂SO₃ + O₂ = 2H₂SO₄
В результате описанных реакций в цилиндре образуется туман из капель серной и сернистой кислот.
- (сернистый водород) H2S, бесцветный газ с запахом тухлых яиц; tпл?85,54 .С, tкип?60,35 .С; при 0 .С сжижается под давлением 1 МПа. Восстановитель. Побочный продукт при очистке нефтепродуктов, коксовании угля и др.; образуется при разложении… … Большой Энциклопедический словарь
- (H2S), бесцветный, ядовитый газ с запахом тухлых яиц. Образуется в процессах гниения, содержится в сырой нефти. Получают действием серной кислоты на сульфиды металлов. Используется в традиционном КАЧЕСТВЕННОМ АНАЛИЗЕ. Свойства: температура… … Научно-технический энциклопедический словарь
СЕРОВОДОРОД, сероводорода, мн. нет, муж. (хим.). Газ, образующийся при гниении белковых веществ, издающий запах тухлых яиц. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
СЕРОВОДОРОД, а, муж. Бесцветный газ с резким неприятным запахом, образующийся при разложении белковых веществ. | прил. сероводородный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Сущ., кол во синонимов: 1 газ (55) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Бесцветный ядовитый газ H2S с неприятным специфическим запахом. Обладает слабокислотными свойствами. 1 л С. при t 0 °C и давлении 760 мм составляет 1,539 г. Встречается в нефтях, в природных водах, в газах биохимического происхождения, как… … Геологическая энциклопедия
СЕРОВОДОРОД - СЕРОВОДОРОД, H2S (молекулярный вес 34,07), бесцветный газ с характерным запахом тухлых яиц. Литр газа при нормальных условиях (0°, 760 мм) весит 1,5392 г. Темп, кипения 62°, плавления 83°; С. входит в состав газообразных выделений… … Большая медицинская энциклопедия
сероводород - — Тематики биотехнологии EN hydrogen sulfide … Справочник технического переводчика
сероводород - СЕРОВОДОРОД, а, м Бесцветный газ с резким неприятным запахом, образующийся при разложении белковых веществ и представляющий собой соединение серы с водородом. Сероводород содержится в некоторых минеральных водах и лечебных грязях и используется… … Толковый словарь русских существительных
Книги
- Сероводород , Джесси Рассел. Эта книга будет изготовлена в соответствии с Вашим заказом по технологии Print-on-Demand. High Quality Content by WIKIPEDIA articles! Сероводоро?д (серни?стый водоро?д, сульфид водорода) -…
- Атмосфера Юпитера , Джесси Рассел. Эта книга будет изготовлена в соответствии с Вашим заказом по технологии Print-on-Demand. High Quality Content by WIKIPEDIA articles! Атмосфе?ра Юпи?тера - крупнейшая планетная атмосфера в…
- Размышления практикующего врача о здоровье работников газовой промышленности , И. В. Фомичев. Светлана Владимировна Фомичева – канд. мед. наук, с. н. с. Института клеточного и внутриклеточного симбиоза УРО РАН. Фомичев Илья Владимирович – врач-гастроэнтеролог, руководитель…
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O 2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O 3 .
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O 2 , прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 o C и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Химические свойства озона:Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах: PbS + 4O 3 = PbSO 4 + 4O 2 Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном: 2Ag + O 3 = Ag 2 O + O 2 Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода: 2KI + O 3 + H 2 O = I 2 ↓ + O 2 + 2KOH |
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы, а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S 8 . Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления.


